化学是一门有趣的学科,但是中考生怎么样复习化学呢?第一要对化学要点进行梳理,下面是我们给大伙筹备的2020年中考化学要点梳理,期望对大伙有所协助。

【篇一】
走进化学世界
1、化学是研究物质的组成、结构、性质以及变化规律的基础科学。
2、物理变化和化学变化的本质不同:有无新物质生成
变化和性质的不同之处:性质中有能可以简单等字眼
3、绿色化学-----环境友好化学
①四特征②核心:借助化学原理从源头消除污染
4、蜡烛燃烧实验
火焰:焰心、内焰、外焰
比较各火焰层温度:用一火柴梗平放入火焰中。现象:两端先碳化;结论:外焰温度
检验产物H2O:用干冷烧杯罩火焰上方,烧杯内有水雾
CO2:取下烧杯,倒入澄清石灰水,振荡,变浑浊
熄灭后:有白烟,点燃白烟,蜡烛复燃
5、吸入空气与呼出气体的比较
结论:与吸入空气相比,呼出气体中O2的量降低,CO2和H2O的量增多
6、学化学的要紧途径科学探究
一般步骤:提出问题猜想与假设设计实验实验验证记录与结论深思与评价
化学学习的特征:关注物质的性质、变化、变化过程及其现象;
7、化学实验
一、常用仪器及怎么使用
可以直接加热的仪器是--试管、蒸发皿、燃烧匙坩埚
只能间接加热的仪器是--烧杯、烧瓶、锥形瓶
测容器--量筒
量取液体体积时,量筒需要放平稳。读数时,视线与量筒内液体凹液面的最低点维持水平。
量筒不可以用来加热,不可以用作反应容器。量程为10毫升的量筒,一般只能读到0.1毫升。
选择适合的量程:所测液体不可以超越量程,也不可以比量程太小为宜
称量器--托盘天平
注意点:先调整零点称量物和砝码的位置为左物右码。称量物不可以直接放在托盘上。
一般药品称量时,在两边托盘中各放一张大小、水平相同的纸,在纸上称量。潮湿的或具有腐蚀性的药品,放在加盖的玻璃器皿中称量。
砝码用镊子夹取。添加砝码时,先加水平大的砝码,后加水平小的砝码
称量结束后,应使游码归零。砝码放回砝码盒。
化学称量,过程中假如出现指针右偏,应该增加药品,而不是降低砝码或移动游码。
加热器皿--酒精灯
酒精灯的采用应该注意三不:①不可向燃着的酒精灯内添加酒精;②用火柴从侧面点燃酒精灯,不可用燃着的酒精灯直接点燃另一盏酒精灯;③熄灭酒精灯应用灯帽盖熄,不可吹熄。
酒精灯内的酒精量不可超越酒精灯容积的2/3也不应少于1/4。
酒精灯的火焰分为三层,外焰、内焰、焰心。用酒精灯的外焰加热物体。
假如酒精灯在燃烧时不慎翻倒,酒精在实验台上燃烧时,应准时用沙子盖灭或用湿抹布扑灭火焰,不可以用水冲。
夹持器--铁夹、试管夹
铁夹夹持试管的位置应在试管口近1/3处。
试管夹夹持试管时,应将试管夹从试管底部往上套;夹持部位在距试管口近1/3处;用手拿住试管夹的长柄,不要把拇指按在短柄上。
分离物质及加液的仪器--漏斗、长颈漏斗
过滤时,应使漏斗下端管口与承接烧杯内壁紧靠,以免滤液飞溅。
长颈漏斗的下端管口要插入液面以下,以预防生成的气体从长颈漏斗口逸出。
【篇二】
二、化学实验基本操作
药品的取用
1、药品的存放:
一般固体药品放在广口瓶中,液体药品放在细口瓶中,
金属钠存放在煤油中,白磷存放在水中
2、药品取用的总原则
①取用量:按实验所需取用药品。如没有说明用量,应取最少量,固体以盖满试管底部为宜,液体以1~2mL为宜。
多取的试剂不可放回原瓶,也不可乱丢,更不可以带出实验室,应放在另一洁净的指定的容器内。
②三不:任何药品不可以用手拿、舌尝、或直接用鼻闻试剂
3、固体药品的取用
①粉末状及小粒状药品:用药匙或V形纸槽②块状及条状药品:用镊子夹取
4、液体药品的取用
①液体试剂的倾注法:取下瓶塞,倒放在桌上,。标签应向着手心,。拿起试剂瓶,将瓶口紧靠试管口边缘,缓缓地注入试剂,倾注完毕,盖上瓶塞,标签向外,放回原处。
②液体试剂的滴加法:
滴管的采用:a、先赶出滴管中的空气,后吸取试剂b、滴入试剂时,滴管要维持垂直悬于容器口上方滴加
c、采用过程中,始终维持橡胶胶帽在上,以免被试剂腐蚀d、滴管用毕,立即用水洗涤清洁
e、胶头滴管采用时千万不可以伸入容器中或与器壁接触,否则会造成试剂污染
连接仪器装置及装置气密性检查
装置气密性检查:先将导管的一端浸入水中,用手紧握容器外壁,若导管口有气泡冒出,松开手,导管口部有水柱上升,就说明装置不漏气。
物质的加热
加热固体时,试管口应略向下倾斜,试管受热时先预热,再集中加热。
加热液体时,液体体积不超越试管容积的1/3,加热时使试管与桌面约成450角,受热时,先预热,然后对着试管里的液体的中下部加热,并且不时地上下移动试管,为了防止伤人,加热时切不可将试管口对着自身或他人。
过滤操作需要注意的地方:一贴二低三靠
一贴:滤纸紧贴漏斗内壁
二低:滤纸的边缘低于漏斗口漏斗内的液面低于滤纸的边缘
三靠:漏斗下端管口紧靠烧杯内壁用玻璃棒导流时,玻璃棒下端轻轻斜靠在三层滤纸的一侧
用玻璃棒导流时,烧杯尖嘴紧靠玻璃棒中部
过滤后,滤液仍然浑浊的可能起因有:①承接滤液的烧杯不清洁②倾倒液体时液面高于滤纸边缘③滤纸破损
蒸发注意点:在加热过程中,用玻璃棒不断搅拌
当液体接近蒸干时停止加热,借助余热将剩余水分蒸发掉,以防止固体因受热而迸溅出来。
热的蒸发皿要用坩埚钳夹取,热的蒸发皿如需立即放在实验台上,要垫上石棉网。
仪器的洗涤:
废渣、废液倒入废物缸中,有用的物质倒入指定的容器中
玻璃仪器洗涤清洁的准则:玻璃仪器上附着的水,既不聚成水滴,也不成股流下
玻璃仪器中附有油脂:先用热的纯碱溶液或洗涤剂洗涤,再用水冲洗。
玻璃仪器中附有难溶于水的碱、碱性氧化物、碳酸盐:先用稀盐酸溶解,再用水冲洗。
仪器洗清洁后,不可以乱放,试管洗涤清洁后,要倒插在试管架上晾干。
【篇三】
大家周围的空气
1、第一个对空气组成进行探究的化学家:拉瓦锡。
2、空气的成分和组成
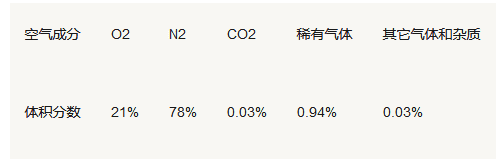
空气中氧气含量的测定
a、可燃物需要:足量且产物是固体
b、装置需要:气密性良好
c、现象:有很多白烟产生,广口瓶内液面上升约1/5体积
d、结论:空气是混合物;O2约占1/5,可支持燃烧;
N2约占4/5,不支持燃烧,也不可以燃烧,难溶于水
e、探究:①液面上升小于1/5起因:装置漏气,红磷量不足,未冷却完全就打开弹簧夹
②能否用铁、铝代替红磷?不可以起因:铁、铝不可以在空气中燃烧
能否用碳、硫代替红磷?不可以起因:产物是气体,不可以产生压强差
3、空气的污染及防治:对空气造成污染的主要是有害气体和烟尘等
现在计入空气污染指数的项目为CO、SO2、NO2、O3和可吸入颗粒物等。
4、空气污染的风险、保护:
风险:紧急损害人体健康,影响作物成长,破坏生态平衡。全球气候变暖,臭氧层破坏和酸雨等
保护:加大高端水平监测,改变环境情况,采用干净能源,工厂的废气经处置过后才能排放,积极植树、造林、种草等
5、现在环境污染问题:
臭氧层破坏温室效应
酸雨白色污染
6、氧气
氧气的化学性质:特有的性质:支持燃烧,供给呼吸氧气与下列物质反应现象

*铁、铝燃烧要在集气瓶底部放少量水或细砂的目的:预防溅落的高温熔化物炸裂瓶底
*铁、铝在空气中不可燃烧。
氧气的制备:
工业制氧气分离液态空气法
实验室制氧气原理2H2O2MnO22H2O+O2
2KMnO4△K2MnO4+MnO2+O2
2KClO3MnO22KCl+3O2
气体制取与采集装置的选择△
发生装置:固固加热型、固液不加热型采集装置:依据物质的密度、溶解性
制取氧气的操作步骤和注意点
a、步骤:查装定点收移熄
b、注意点
①试管口略向下倾斜:预防冷凝水倒流引起试管破裂②药品平铺在试管的底部:均匀受热
③铁夹夹在离管口约1/3处④导管应稍露出橡皮塞:便于气体排出
⑤试管口应放一团棉花:预防高锰酸钾粉末进入导管
⑥排水法采集时,待气泡均匀连续冒出时再采集
⑦实验结束时,先移导管再熄灭酒精灯:预防水倒吸引起试管破裂
⑧用排空气法采集气体时,导管伸到集气瓶底部
氧气的验满:用带火星的木条放在集气瓶口检验:用带火星的木条伸入集气瓶内
7、催化剂:在化学反应中能改变其他物质的化学反应速率,而本身的水平和化学性质在反应前后都没有发生变化的物质。
催化剂在化学反应中所起的用途叫催化功效。
8、容易见到气体的功效与作用:
①氧气:供给呼吸
支持燃烧
②氮气:惰性保护气、要紧材料、液氮冷冻
③稀有气体:保护气、电光源、激光技术
9、容易见到气体的检验办法
①氧气:使带火星的木条复燃②二氧化碳:使澄清石灰水变浑浊
③氢气:将气体点燃,用干冷的烧杯罩在火焰上方;或者,先通过灼热的氧化铜,再通过无水硫酸铜
10、氧化反应:物质与氧发生的反应。
剧烈氧化:燃烧
缓慢氧化:铁生锈、人的呼吸、事物腐烂、酒的酿造






